Autor: Roman Špeta · 11.2.2008 · Článek #183 ·
Voda, taková obyčejná a samozřejmá věc. Bez vody by nebyl na Zemi život, koneckonců i člověk je z 80 % tvořen z vody. Voda znamená také základní zdroj života pro ryby a rostliny. Zkusme si alespoň v jednoduchosti shrnout základní a pro nás akvaristy důležité poznatky o vodě, o jejím měření a úpravách.Různé zdroje vody mají různé vlastnosti. Měříme její tvrdost, alkalitu, vodivost, kyselost nebo zásaditost a pro akvaristické účely i obsah dusitanů, dusičnanů, železa a jiných anorganických látek. V neposlední řadě i obsah oxidu uhličitého.
Hodnoty vody jsou ovlivňovány vlastností půdy v příslušné oblasti. Mořská voda je díky množství rozpuštěných minerálních látek mimořádně tvrdá, u říčních vod je tomu trochu jinak. Např. u vod Jižní Ameriky prakticky chybí v podloží vápenec, proto je voda velmi měkká. Díky bažinám při záplavách, tlejícímu listí, dřevu a různým organismům, se tvoří huminové kyseliny a kyselina uhličitá, tím je voda kyselá. Naproti tomu africká jezera Malawi a Tanganyika mají díky rozpuštěným minerálům vodu tvrdou a vzhledem k absenci tlejících procesů i zásaditou. Tím se pomalu dostáváme k ukazatelům jakosti vody.
Tvrdost vody
Podle celkového obsahu solí ve vodě rozlišujeme vodu na:
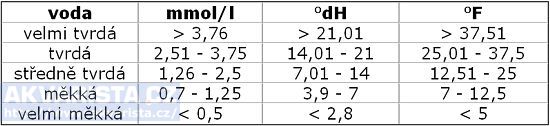
Informace o vodě jsou většinou uváděny v jednotkách mmol/l (vodárny), někdy ve francouzských stupních (°F), které se ovšem používají zřídka. V akvaristice se měří podle německých stupňů (°dH).Tabulka přepočtů je zde:
1 mmol/l = 5,6°dH
1°dH = 0,18 mmol/l
1 mmol/l = 10°F
1°F = 0,1 mmol/l
1°dH = 1,7°F
1°F = 0,56°dH
Tvrdost vody dělíme na stálou (síranovou), nebo přechodnou (karbonátovou, uhličitanovou).
Stálá (síranová) tvrdost
Je dána koncentrací kationtů vápníku a hořčíku ve vodě. Tvoří ji hlavně síran vápenatý a síran hořečnatý. K jejich odstranění používáme srážení působením hydroxidu vápenatého a uhličitanu sodného, čímž se rozpustné hydrogenuhličitany a sírany převedou na méně rozpustné uhličitany - uhličitan vápenatý a hydroxid hořečnatý.
Odstranit stálou (síranovou) tvrdost vody můžeme pomocí iontoměničů (anexy, katexy) v demineralizačních kolonách, a to dvěma způsoby.
1) Buď v jednoduché (jednoválcové) koloně (v tzv. Na cyklu), kdy jsou soli vápníku a hořčíku nahrazeny ekvivalentním množstvím sodných solí. Tato voda bude mít nižší uhličitanovou i celkovou tvrdost,ale bude v ní zachován vysoký obsah solí. Toto je částečná demineralizace.
2) Nebo v klasické (dvouválcové) koloně tzv. cyklu OH- a H+, kdy silně kyselé katexy v cyklu H+ zachycují všechny kationty a mění je za anionty vodíku a silně bazické anexy v cyklu OH- zachycují všechny anionty a mění je za ionty hydroxylové. Jednoduše, ionexové odstraňování všech kationtů a aniontů z vody, včetně sloučenin křemíku. Tato voda má velmi nízkou uhličitanovou i celkovou tvrdost, ale i díky velmi nízkému, až nulovému obsahu solí, také mizivou vodivost do 5µS/cm. Toto je demineralizace úplná.
Další možností je použít reverzní osmózu. Ta je založena na využívání jevu zvaného osmóza. Jestliže jsou v přírodních podmínkách (to jest bez dodatečného tlaku) dva roztoky s rozdílnou koncentrací látek v nich rozpuštěných (např. voda s vyšším a nižším obsahem soli) odděleny polopropustnou membránou, pak molekuly čisté vody začnou přes tuto membránu přecházet z roztoku méně koncentrovaného do roztoku koncentrovanějšího, dokud se koncentrace roztoků na obou stranách membrány nevyrovná. Na membránu přitom působí tlak přecházejících molekul - tzv. osmotický tlak. Když však na koncentrovaný roztok působíme tlakem vyšším než je osmotický tlak, pak voda proudí opačným směrem a z koncentrovaného roztoku prochází čistá voda na druhou stranu membrány, zatímco rozpuštěné látky jsou odváděny do odpadu. Toto je také demineralizace úplná, avšak s vyšší (pro chov choulostivých druhů dostačující) vodivostí do 15µS/cm. Jedinou nevýhodou je, že na jeden díl demineralizované vody z reverzní osmózy jsou až tři díly vody odpadní.

Stálou tvrdost vody můžeme snížit mícháním s vodou demineralizovanou, destilovanou, dešťovou, nebo vodou z horských potoků. Pokud máme ve štěrku obsažen vápník, nebo hořčík, snížení tvrdosti bude složitější, neboť se nadále bude dostávat do vody, a zvyšovat její tvrdost. Přítomnost vápníku ve štěrku zjistíme klasickým octovým testem, kdy štěrk ve skleničce zalijeme octem zhruba 1 cm nad štěrk, a pokud štěrk perlí i po 1-2 hodinách, je nevhodný pro ryby z měkkých vod.
Zvýšit ji můžeme přidáním vápence, dolomitu, ulit, nebo drceného korálu. Při zvyšování tvrdosti vody zvyšujeme i její vodivost resp. mineralizaci.
Přechodná (karbonátová či uhličitanová) tvrdost vody
Přechodná, nebo také karbonátová či uhličitanová tvrdost vody, nebo také alkalita, je dána obsahem všech zásaditě reagujících látek. Největší význam má hydrogenuhličitan vápenatý a hořečnatý. Akvarijními testy měříme v podstatě alkalitu, i když je na obalu napsána uhličitanová tvrdost vody. Pro orientační měření se používají, ale o skutečné přechodné tvrdosti vypovídají jen přibližně. Vzhledem k tomu, že přechodná tvrdost nemůže být větší než alkalita, zjistíme jen maximální možnou hodnotu přechodné tvrdosti. Skutečná hodnota přechodné tvrdosti však bývá i podstatně nižší než naměřená hodnota alkality.
Alkalita nebo také kyselinová neutralizační kapacita (KNK) je vlastně mírou acido-bazické stability, dané hodnotou pH. Mluvíme o ní také jako o pufrační (tlumivé) kapacitě vody. Pufry (tlumiče) jsou látky, které mají schopnost neutralizovat kyseliny a zásady a udržují stabilitu resp. hodnotu pH na určité úrovni.
Přechodnou tvrdost (alkalitu) vody snížíme převařením vody, kdy se vysráží tzv. kotelní kámen, ředěním vstupní vody vodou demineralizovanou, nebo destilovanou, dešťovou či použitím rašeliny (sníží se pH i alkalita). Přechodnou tvrdost zvýšíme také například přidáním jedlé sody.
Zásaditost nebo kyselost vody (hodnota pH)
Každá voda je zásaditá nebo kyselá - resp. neutrální. Jejím měřítkem je hodnota pH. Nositeli kyselých a zásaditých vlastností ve vodě jsou ionty H+ a OH-. Pokud je ve vodě jejich stejné množství, připadá na každý z nich 10-7mol/l, nazýváme tuto vodu neutrální, zkráceně hodnota pH = 7. Voda pod hodnotu pH 7 je kyselá, nad hodnotu pH 7 zásaditá. Extrémní hodnoty pH jsou v rozsahu 0-14, kdy platí, že 0 je velmi silná kyselina a 14 je velmi silná zásada. Snižující se koncentrací H+ve vodě její pH stoupá a naopak.
Hodnotu pH přírodních vod tvoří rozkládající se vegetace (kyselost), nebo rozpuštěné minerály (zásaditost).
Hodnota pH v akváriu během dne kolísá a to o 1-2 stupně. Je to díky asimilační činnosti rostlin. Během dne přijímají ve vodě rozpuštěný oxid uhličitý (CO2) a vydávají kyslík, hodnota pH se zvyšuje. V noci přijímají rostliny kyslík a obsah CO2 ve vodě se opět zvyšuje, tím hodnota pH klesá. Proto se aplikace CO2 v noci nedoporučuje, může nastat otrava ryb v nádrži.
Hodnotu PH můžeme upravovat, ale je třeba počítat s pufrační (tlumivou) schopností vody. Pro úpravu dobře pufrované vody bude zapotřebí dávkovat větší množství kyseliny nebo zásady. Získaná hodnota pH může být nestabilní a bude mít tendenci se vracet k původním vyšším hodnotám, což má špatné důsledky pro obyvatele akvária. Máme-li vodu s vysokou pufrační kapacitou, musí úpravě pH předcházet snížení alkality.
PH snižujeme aplikací CO2, přidáním některé kyseliny (fosforečné, chlorovodíkové, sírové, kde ale platí, že se zároveň zvýší vodivost, protože roste obsah solí rozpuštěných ve vodě), smícháním s vodou s nízkým pH (dešťová, demineralizovaná), filtrací přes rašelinu, nebo komerčními přípravky (pH-,Aquahum, Torumin atd.).
Zvyšovat pH lze vápencem, korálovou drtí(dojde ke zvýšení tvrdosti,alkality a následně i pH), použitím jedlé sody, mořské soli, nebo i řádným provzdušňováním vody, kdy je vyháněn přebytečný CO2 z vody, pokud se jedná o dobře zarostlou nádrž. A samozřejmě zde máme komerční přípravky, jako třeba pH+.
Konduktivita (vodivost) vody
Konduktivita (vodivost) je převrácená hodnota odporu a měříme jí konduktometry v jednotkách mikrosiemens(µS).
Konduktivita vody je dána obsahem všech vodivých látek obsažených ve vodě. Jsou to především kyseliny, zásady a jejich soli, ze kterých štěpením (disociací) vznikají elektricky nabité částice-ionty. Vodivost úzce souvisí s osmotickým tlakem, to znamená obsahem elektrolytů ve vodě. Velmi zjednodušeně řečeno, osmotický tlak je tendence vody přecházet skrze polopropustnou membránu do roztoku, jak bylo popsáno výše. Osmotický tlak má velký vliv na vývoj jiker a zárodků.
Účinek osmotického tlaku lze vysvětlit i takto:
Jestliže se zárodek budoucí ryby nachází ve vodě chudé na soli (v hypotonickém roztoku), má snahu čerpat vodu ze svého okolí do svého těla, které je relativně "slanější". Zárodek neúměrně zvětšuje svůj objem, jeho životní funkce jsou narušeny a nakonec hyne. Obráceně, nachází-li se rybí zárodek ve vodě s vysokým obsahem soli (v hypertonickém roztoku), je svým okolím "odvodňován", nežádoucím způsobem zmenšuje svůj objem a rovněž hyne. Čím vyšší je koncentrace rozpuštěných solí ve vodě, tím vyšší je osmotický tlak.
V běžné akvaristice není potřeba tyto hodnoty znát, pouze při odchovu choulostivějších druhů ryb, např. Symphysodon, Paracheirodon, nebo některých asijských razbor.
Dusíkaté látky (NO2, NO3)
Jak se dusíkaté látky v akváriu objevují? Ryby vylučují exkrementy a moč, odumíráním částí rostlin, roli hrají i zbytky potravy, nebo kořeny a větve stromů. Tyto se ve vodě rozkládají, moč a exkrementy se rozpouštějí.
Prvním stupněm organicky vázaného dusíku je amoniakální dusík: amonné sloučeniny amonium(NH4) a zároveň nejjedovatější amoniak(NH3). Ve vodě se amoniak rozpouští a vytváří zásaditě reagující roztok. Na ryby toxicky působí amoniak(NH3), nikoli amonné ionty NH4. Čím vyšší je pH vody, tím větší je pravděpodobnost takové otravy. V akváriu s kyselou vodou nemůže k otravě amoniakem prakticky dojít.
Dalším stupněm je přeměna amoniaku přes dusitany (NO2) na dusičnany (NO3).
Amoniakální dusík odbourávají bakterie Nitrosomonas a Nitrosococcus a přemění(oxiduje) ho na dusitany(NO2). Přeměnu dusitanů (NO2) na dusičnany (NO3) zajišťují bakterie rodu Nitrobacter a Nitrocystis. Tento proces se nazývá nitritace a nitratace. Konečný produkt nitrifikace-dusičnany se odstraňují při každé výměně vody. Zcela odstranit jdou pouze pomocí syntetických pryskyřic (iontoměničů), ale nesmíme zapomenout, že dusičnany jsou základním stavebním kamenem pro růst rostlin.
Někdy se může stát,že se dusičnany zredukují zpět na dusitany. Je to v případě, kdy z nějakého důvodu uhynou nitrifikační bakterie, akvárium je nedostatečně osvětlené, málo zarostlé a provzdušněné a bez pravidelné výměny vody. Celý proces bývá provázen poklesem hodnoty pH. Riziko otravy amoniakem a dusitany snížíme pravidelnou částečnou výměnou vody a kvalitní filtrací.
Oxid uhličitý (CO2)
Ve vodě rozpuštěný oxid (kysličník) uhličitý, tvoří slabou kyselinu uhličitou, která činí vodu kyselou a slouží jako "hnojivo" pro rostliny. V přírodě je kyselina uhličitá v různém množství, jak ve vázané, tak v rozpuštěné formě, tvoří se rychlou humifikací (rozkladem) organických látek, nebo se i při dešti obohatí voda o volný CO2. Potřebujeme jí proto, aby udržovala vápenec v částečně rozpuštěné formě, kterou přijímají rostliny, jako živiny.
Měření CO2 má smysl pro rostlinná akvária, kdy rostliny přijímají ve vodě rozpuštěný CO2 a za pomoci světla produkují kyslík. Tento proces, se nazývá asimilace rostlin, jinak, fotosyntéza. Fotosyntéza je schopnost zelených rostlin vytvářet z anorganických látek pomocí světla složité látky organické.
Pokud je přívod CO2 do akvária vysoký, sníží se pH vody. Občas (při nedostatku CO2) dochází k vysrážení vápenatých sloučenin na horní straně listů. Tento jev nazýváme biogenním odvápněním, nebo asimilací hydrogenuhličitanů (schopnost uvolnění CO2 z kovů alkalických zemin). Je tím silnější, čím vyšší je uhličitanová tvrdost vody, při současně silném osvětlení nádrže. V takové situaci vzniká nedostatek CO2 a celý děj probíhá obráceně. Pokud není k dispozici CO2, ani kyselina uhličitá, přijímají rostliny spodní stranou listů hydrogenuhličitan vápenatý, odebírají z něj kyselinu uhličitou a na své svrchní straně vylučují uhličitan vápenatý. Uhličitanová tvrdost se snižuje, ale pH stoupá. To které je dáno odčerpáním volného oxidu uhličitého a tím i kyseliny uhličité z vody.
PH může za určitých podmínek stoupnout až k 11-12. Tyto hodnoty jsou pro většinu obyvatel akvária smrtelné, jedná se o tzv. "louhovou chorobu". V měkké vodě se rostlinám daří hůře. Tím, že prakticky chybí uhličitan vápenatý, chybí pufr pro kyselinu uhličitou. Tady se aplikace CO2 doporučuje, aby měly rostliny dostatek výživy, protože je to jediný zdroj uhlíku. V noci asimilace rostlin neprobíhá, proto je lepší vypínat zařízení na CO2. Mohlo by dojít k otravě ryb.
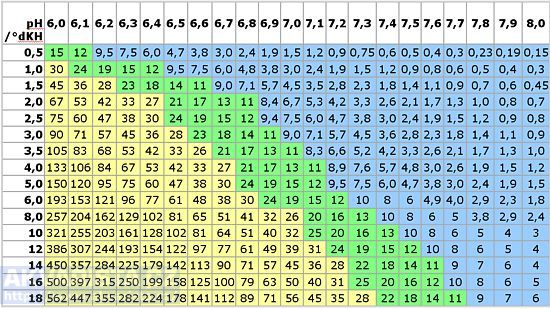
K výpočtu obsahu CO2 ve vodě,můžeme požít Tillmanovu tabulku.
Měření vlastností vody
V akvarijní vodě měříme:
- GH (celkovou tvrdost)
- KH (uhličitanovou tvrdost, alkalitu)
- pH (kyselost, či zásaditost vody)
- NO2 (dusitany)
- NO3 (dusičnany)
- CO2 (oxid uhličitý)
- P/PO4 (fosfor/fosfátů)
- NH3/NH4 (amoniak/amonium)
- Ca (vápník)
- Fe (železo)
- Cu (měd)
- Cl (chlór)
- Vodivost
mg+:3549]
Skoro všechny tyto hodnoty měříme kolorimetrickými kapkovými testy, k dostání v každé akvaristice.
Hodnotu pH a vodivost můžeme měřit elektronickými měřícími přístroji, pH metry a konduktometry.
mg+:3548]
Připomněli jsme si, jaké hodnoty vody se měří a jak je jednoduše upravit. Vše samozřejmě záleží na tom, jaké druhy chceme chovat a jakou máme vstupní vodu. Nejjednodušší je změřit si parametry vody a pak se rozhodnout, jaké druhy je nejvhodnější chovat. Pro většinu druhů tvrdost vody a reakce pH nemá takový význam, pokud leží v rozmezí 6-15°dH a 6-7,5 pH. Jsou však rybky, které mají vysoké nároky na kvalitu vody, hlavně při odchovu.
Protipóly v přírodě
Na závěr několik protipólů parametrů vody s ukázkami některých jejích obyvatel.
Velmi měkkou vodu, do 1°dGH, do 0,3°dKH, 5,5-6,2 pH a vodivost do 10 µS vyžadují k odchovu ryby rodu Symphysodon, Paracheirodon, některé druhy rodu Apistogramma, měkkou vodu mají rády i Pterophyllum, některé razbory z jihovýchodní Asie a halančíci rodu Aphyosemion. Taková voda se nachází v povodí Amazonky, v Nigérii, nebo v Kamerunu.
mg+:3546]
Na druhou stranu, jsou rybky, které potřebují vodu tvrdší a zásaditou. Jsou to rybky z jezer Malawi. Tvrdost 4-8°dGH (6-7°dKh), 7,7-8,8 pH a vodivost 210-235 µS. Daří se zde druhům Labeotropheus, Melanochromis, nebo Pseudotropheus.
mg+:3547]
Nebo Tanganika, tvrdost 7-12°dGH (10-18°dKh), 7,5-9,2 pH a vodivost 606-620µS.Zde se daří druhům Julidochromis, Neolamprologus, Tropheus nebo Cyprichromis.
Jsou rybky, které jsou uvyklé nároky i na lehce brakickou vodu, jsou to např. Poecilia, Monodactylidae, nebo Scatophagidae.
Myslím, že je potřeba znát, jakou vodu máme k dispozici z vodovodního řadu, nebo vlastní studny. Podle toho bychom se měli rozhodovat, jaké rybky si pořídíme, aby se cítily co nejlépe a my měli co nejmenší práci s úpravou vody.
Aktuální kvalitu vody v Pražské vodovodní síti naleznete zde: http://www.pvk.cz/...
Snažil jsem se ve velmi zjednodušené formě popsat vlastnosti vody, tak, aby se v tom mohl orientovat i méně zkušený akvarista, pochopit její základní zákonitosti, měření a úpravu. Čerpal jsem z vlastních zkušeností, internetu i z knih Stanislava Franka a Ines Scheurmannové...